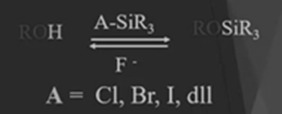Deprotector
Setelah dilakukan proteksi maka
selanjutnya adalah deprotektor, yaitu sebuah reaksi menjelang selesai, dimana
tentunya gugus pelindng harus di buang, supaya di harapkan mendapatkan senyawa
prodak yang di harapkan atau sebagai molekul target sehingga di butuhkan
deprotektor. Deprotektor Adalah swnyawa
yang berfungsi membuang gugus pelindung. Deprotektor atau zat atau juga senyawa
yang berfungsi membuang gugus pelindung yang di gunakan
Deproteksi gugus
protector
Jika
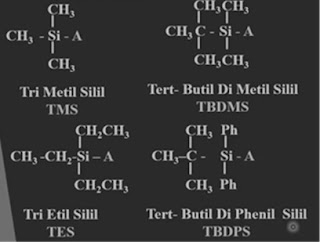
ingin di lepaskan kembali maka di butuhkan deprotector, TBDMS yang akan di
lepaskan senyawa yang mampu melepaskan gugus-gugus pelindung terhadap gugus
alkohol senyawanya kita dapatkan tetrabutil amonium klorida atau disingkat TBAF
atau digunakan piridin dan asam florida atau atau asam florida atau ammonium
florida kita dapatkan bahwa senyawa-senyawa yang mengandung ion florida akan
melepaskan gugus protector dari alkohol dari kelompok-kelompok sili, nanti di
dapatkan deprotector yang digunakan pada
proses pelepasan protector gugus pelindungdari alkohol yang kita dapatkan Tris (dimetil
Amino) Sulfonium di fluoro trimetil silikat ( TASF) untuk senyawa senyawa yang
di gunakan untuk melepas gugus pelindung atom dari senyawa senyawa senyawa
senyawa yang digunakan untuk berikutnya mekanisme proteksi mekanisme pelepasan
gugus pelindung mekanisme pasar yang mendekati gugus hidroksil ini kita
Mekanisme
pelepasan gugus yang membekap gugus hidroksil kita dapatkan untuk senyawa alkohol
yang sudah terdekat atau terproteksi dengan kehadiran Silil kita siapin senyawa
asam klorida H-F, asam klorida untuk ion florida akan menyerang akan berikatan
dengan silicon sehingga kita dapat kan nanti ada ion H+ positif yang bebas floridanya
terikat langsung ke silicon dan silikonnya menjadi bermuatan negatif ada yang H+
positif dan kemudian dalam kondisi seperti ini nanti oksigen sebagai unsur
elektron negatif dari silikon akan menarik elektron ke oksigen sehingga kita
dapatkan kondisinya menjadi R-O minus atau alkanolat sebagai ion negative dan
silikonnya sudah netral tapi di dalam larutan masih di dapatkan ada ion positif
dari ion H+ yang berasal dari H-F nah
ini nanti akan menyatu dengan alkanolat R-O minus menjadi alkohol ilustrasi mekanisme deproteksi
dari gugus pelindung dari senyawa alkohol
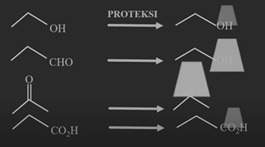
Aplikasi proteksi alkohol
Aplikasi
proteksi dan deroteksi terhadap gugus alkohol proteksi dan deproteksi terhadap
gugas alkohol ini kita dapatkan menggunakan senyawa-senyawa silil misalnya kita dapatkan untuk senyawa yang
mengandung gugus hidroksil dan gugus keton O ini menjadi molekul target dan OH ini
menjadi molekul yang ingin kita sintesis kita berharap ada gugus karbonil dan
gugus alkohol dari molekul target atau namanya 4 hidroksi 2 butanon tetapi kita
hanya memiliki bahan baku dari senyawa yang kita dapatkan senyawanya 1,3-butanadiol,
gugus hidroksil yang terakhir pada rantai karbon tetap utuh dari senyawa
butanon , maka gugus hidroksi dari material bahan baku harus dipertahankan
sementara gugus hidroksi dari gugus hidroksi alkohol pada karbon yang ketiga
ini pada akhir reaksi mau dirombak menjadi keton maka untuk alkohol sebagai
alkohol primer dari karbon yang terakhir posisi yang pertama ini harus di
pertahankan bagaimana caranya supaya
tetap ada di akhir kita harus kita harus proteksi kita gunakan protektornya
dari senyawa tersier butil dimethyl silils klorida, nanti klorida akan berikatan
dengan hydrogen dan TBDMS akan berikatan degan Oksige dari gugus hidroksil dari
maka gugus hidroksil dari alkohol primernya akan terproteksi kemudian baru kita
lanjutkan untuk reaksi merombak hidroksil sebagai alkohol sekunder nya menjadi
keton tentunya kita oksidasi kita oksidasi menggunakan PCC atau piridin chloro
cromat ini merupakan reaksi yang sangat selektif untuk oksidasi alkohol menjadi
aldehid dan keton kemudian kita dapatkan setelah ditambah PCC maka hidroksil
berubah menjadi gugus keton tetapi protect masih tetap kehadirannya dalam
molekul
Kalau
kita ingin lepaskan maka tentunya kita gunakan D protector supaya didapatkan
hasil akhir finish menjadi senyawa butanon kita dapatkan menjadi 4 hidroksi 2
butanon, karena posisi dari karbonil menjadi posisi karbon nomor dua dari sini kita
gunakan untuk kita gunakan protektornya TBAF dapatkan nanti untuk tersier butil
dimetil silil lepas dan akan terbentuk
kembali hidroksil pada gugus sebagai alkohol primernya, ilustrasi kalau ingin
membuat prodak yang mengandung gugus keton dan hidroksil sementara bahan baku
kita kita dapatkan ada dua gugus hidroksil salah satunya harus kita oksidasi si
dan salah satunya dipertahankan cara mempertahankannya kita gunakan protector
setelah selesai dioksidasi baru lepaskan dengan ion Florida, tersier butyl Amin
Florida baru akan terbentuk menjadi alkohol kembali
berikut link video penjelasan saya :
permasalahan :
1. Dapatkah saudara jelaskan, apakah deproteksi itu penting ? jelaskan!
2. Menurut saudara didalam kehidupan sehari hari, apakah deproteksi ini memiliki manfaat. ?
3. Dari beberapa literature yang saya baca, mengapa kebayakan deproteksi menggunakan asam kuat.?